细胞凋亡
1.细胞凋亡的概念
细胞凋亡(Cell apoptosis)是一个主动的由基因决定的细胞自动结束生命的过程,是细胞为维持内环境稳定而有序性地死亡,它涉及一系列基因的激活、表达和调控等作用,具有生理性和选择性的。
2.细胞凋亡的特征
(1)形态学变化:最初细胞体积缩小,细胞间接触消失,与周围细胞脱离;之后是细胞质密度增加,核质浓缩,核膜、核仁破裂,胞膜有小泡形成,胞膜结构依旧完整,最终可将凋亡细胞分割包裹成几个凋亡小体,无内容物外溢;凋亡小体可以被周围专职或非专职的吞噬细胞吞噬。
(2)生物学变化:DNA发生有控降解,片段化的DNA片段为180-200bp的整倍数;在细胞凋亡的过程中,也常有新的基因的表达和某些生物大分子的合成作为调控因子。
3.细胞凋亡的生理意义
(1)维持多细胞生物个体发育的正常进行;
(2)保持自稳平衡;
(3)抵御外界各种因素的干扰。
02
细胞凋亡的检测方法
1
1.形态学观察
根据凋亡细胞固有的形态特征,用台盼蓝、DAPI或Giemsa染色,然后在光学显微镜下观察,或直接在电镜下观察。
2.DNA片段化检测
细胞发生凋亡时,DNA发生特征性的核小体间的断裂,产生大小不同的片段,但都是180~200bp的整数倍,在凝胶电泳上表现为梯形电泳图谱(DNA ladder)。细胞经处理后,采用常规方法分离提纯DNA,进行琼脂糖凝胶电泳和溴化乙啶染色,在凋亡细胞群中可观察到典型的DNA ladder。
3.彗星电泳法
彗星电泳的原理是将单个细胞悬浮于琼脂糖凝胶电泳中,经裂解处理后,产生大小不同的片段,再在电场中进行短时间的电泳,并用荧光染料染色,凋亡细胞中形成的DNA断裂片段,在电场中游动速度较快,使细胞核呈现出一种彗星式图案。
4.TUNEL测定法
即DNA断裂的原位末端标记法,细胞凋亡中,染色体DNA双链断裂或单链断裂而产生大量的粘性3'-OH末端,可在脱氧核糖核苷酸末端转移酶的作用下,将脱氧核糖核苷酸和荧光素、过氧化物酶、碱性磷酸酶或生物素形成的衍生物标记到DNA的3'-OH末端,从而可进行凋亡细胞的检测。由于正常的或正在增殖的细胞几乎没有DNA的断裂,因而没有3'-OH形成,很少能够被染色。可用于石蜡包埋组织切片、冰冻组织切片、培养的细胞和从组织中分离的细胞的形态测定,并可检测出极少量的凋亡细胞。
5.流式细胞分析法
磷脂酰丝氨酸(PS)正常位于细胞膜的内侧,但在细胞凋亡的早期,PS可从细胞膜的内侧翻转到细胞膜的表面,暴露在细胞外环境中。Annexin-V是一种分子量为35~36KD的Ca2+依赖性磷脂结合蛋白,能与PS高亲和力特异性结合。将Annexin-V进行荧光素(FITC、PE)或biotin标记,以标记了的Annexin-V作为荧光探针,利用流式细胞仪或荧光显微镜可检测细胞凋亡的发生。碘化丙啶(propidine iodide,PI)是一种核酸染料,它不能透过完整的细胞膜,但在凋亡中晚期的细胞和死细胞,PI能够透过细胞膜而使细胞核红染。因此将Annexin-V与PI匹配使用,就可以将凋亡早晚期的细胞以及死细胞区分开来。
6.Countstar Rigel 检测法
结合Annexin-V FITC和PI染色液,对细胞样品进行处理,然后在Rigel 仪器上进行检测,然后流式分析导出,在FCS类流式软件上进行分析,得到散点图结果。

其实验步骤如下:
①每个样品收集约30~50万个细胞于1.5毫升离心管内(如细胞密度为100 万个/mL,则取500微升体积悬液用于后续实验);将细胞在400g转速条件下离心3分钟,弃上清,用200微升PBS进行重悬;用移液枪轻轻吹打混匀,400g转速条件下离心3分钟,弃上清,用 100 微升Annexin V Binding Buffer重悬;
②向细胞悬液中加入1.5微升Annexin-V-FITC染色液;
③加入4微升PI染色液;
④混匀,室温避光孵育10~15分钟;
⑤400g转速条件下离心3分钟,弃上清,用100微升Annexin V Binding Buffer进行重悬;
⑥400g转速条件下离心3分钟,弃上清,用100微升Annexin V Binding Buffer进行重悬;
⑦在30分钟内完成检测,检测之前,避光保存。吸取20微升悬液,加入细胞计数板,插入仪器样品槽里,选择“细胞凋亡”实验类型,进行检测;流式分析导出,在FCS软件上进行分析,如图1和2。
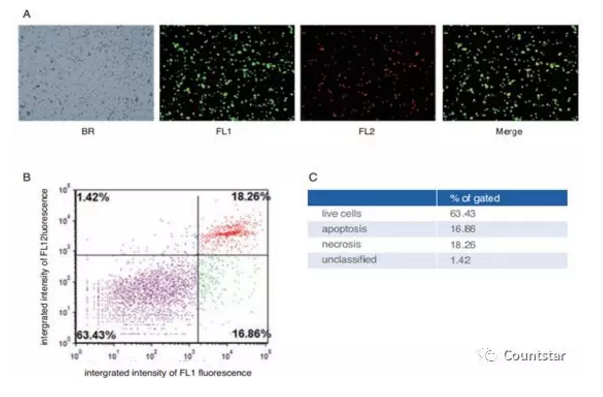
图1.A Rigel 检测的凋亡荧光图片结果;B FCS软件分析得到的散点图;C 细胞不同状态所占比
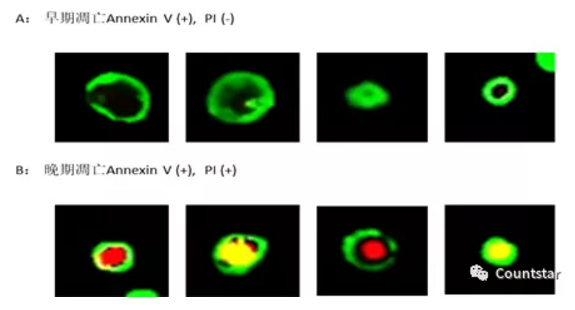
图2. Rigel所摄凋亡细胞检测图片

(PS: 仅限于研究用途, 不可用于诊断操作)


