CAR-T细胞治疗监管概述
近年来,细胞治疗产品,尤其是嵌合抗原受体T细胞(CAR-T)的研发与临床应用发展迅猛。在美国临床试验网站检索全球CAR-T细胞治疗临床试验登记数可以发现,中国所登记的项目数仅次于美国,居全球第二。迄今为止,国内已有近二十家公司拿到了CAR-T细胞疗法的临床批件[1]。
在细胞治疗领域方面的监管,我国借鉴发达国家的经验,正在努力推动CAR-T细胞产品的全生命周期监管。2017年12月,《细胞治疗产品研究与评价技术指导原则(试行)》发布[2],对细胞产品的制备工艺提出了高要求,建立了细胞治疗产品按药品途径申报的指导原则。应当注意的是,细胞制品如CAR-T细胞疗法与一般药品相比,仍需额外的监管,其中最重要的部分是安全问题。2019年11月28日,国家药品监督管理局食品药品审核查验中心官网重磅发布《GMP附录-细胞治疗产品》(征求意见稿)[3],这是国内首部针对细胞治疗产品的GMP附录,弥补了我国对细胞治疗产品生产质量控制法规层面和技术层面的空白。
CAR-T细胞产品生产过程
CAR-T 产品生产主要分为三个生产过程:
-
质粒生产:在CAR-T产品的生产过程中,如有质粒中间品,应有独立的质粒生产区;
(1)至少包括细菌复苏、细菌扩增、细菌破碎、质粒纯化和除菌过滤等工艺流程;
(2)质粒生产区内应至少包括发酵、纯化和除菌分装三个功能区,其中发酵和纯化功能区至少为控制区,除菌分装功能区的洁净度至少为“C+A”;
(3)应注意消毒灭菌工作,以避免不同种质粒或不同批次质粒的交叉污染。
-
病毒载体生产:
(1)至少包括细胞扩增、质粒转染(如有)、病毒收获、病毒纯化和除菌过滤等工艺流程;
(2)病毒载体生产区应至少分为细胞培养、病毒转染、病毒纯化和除菌过滤等功能区;
(3)病毒载体的生产区应符合药品 GMP 要求,应注意消毒灭菌工作,以避免不同批次的交叉污染及外源性微生物污染。
-
CAR-T 产品生产:
(1)至少包括细胞分离、细胞分选(如有)、T 细胞激活、病毒感染、细胞扩增、细胞收获和细胞冷冻(如有)等工艺流程;
(2)CAR-T产品生产区应至少分为体细胞分离分选、细胞扩增和细胞冷冻等功能区;
(3)CAR-T产品的生产区应符合药品GMP要求,CAR-T产品的生产应符合无菌技术操作规范。
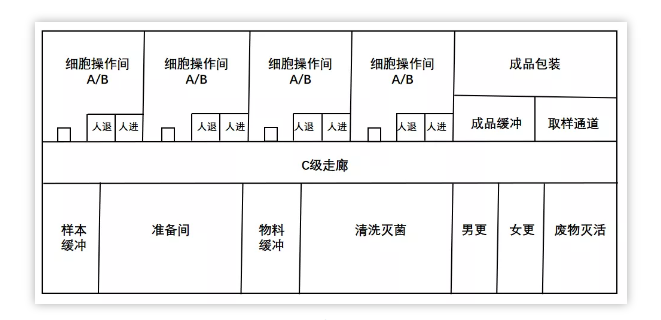
细胞操作区,是用于进行CAR-T细胞产品的生产操作的区域,包括T细胞分离、基因修饰、细胞培养扩增、制剂分装等。1个细胞操作间,同一时间只能生产1个批次的产品,细胞操作时间约2~3 h,培养时间约10~15天。房间环境洁净级别为B级,应注意避免交叉污染。生物废弃物收集到密闭的袋子或容器,经废物通道转移到C级区,使用双扉式湿热灭菌柜进行灭活处理。
质粒、病毒载体和 CAR-T 产品的生产区应分别设置为独立区域,病毒载体和 CAR-T 产品的生产不应共用空调净化系统。除了生产区域,还需包括质控区和储存区,质控区包括支原体、内毒素、无菌、微生物限度、阳性对照、流式细胞仪和分子生物学等相关检测,储存区包括病毒、菌种和细胞储存。
CAR-T生产过程对空间灭菌的需求
根据国家出台的相关政策,CAR-T的临床生产必须在一个“B+A”的环境中,相对于传统药品的管理,结合CAR-T细胞疗法自身的一些特点,如何保证这类产品的安全、有效和质量可控具有极大的挑战性,也对空间灭菌提出了更严格的要求。
CAR-T细胞治疗不同于传统药物,是一种基于整合了CAR基因的自体T细胞疗法,生产过程需无菌操作,属于非最终灭菌的无菌产品,且不能无菌过滤。
选择CAR-T细胞治疗的病人一般都处于肿瘤的终末期,时间就是生命,必须在尽可能短的时间内完成从抽血到给药的过程,同时对CAR-T的药物安全和质量要求较高。
CAR-T细胞治疗属于个性化治疗产品,一个病人就是一个批次,生产规模不大,生产周期较短,灭菌需求灵活多变:对灭菌循环的周期和批次要求非常高,批次之间对环境进行消毒灭菌不仅要彻底,还必须在时间上比较迅速,这也就限制了一些传统的消毒灭菌方式的应用,比如甲醛灭菌停产周期较长且有残留和紫外消毒效果无法保证。
气化过氧化氢灭菌技术已成为各国药典、GMP、消毒灭菌技术规范所推荐的方法,灭菌工艺已经非常成熟,重复性好,有专门的化学指示剂和生物指示剂验证过氧化氢气体分布均匀情况和无菌保证水平。而干法移动式的VHP灭菌设备因其灭菌效果好,物料兼容性优,最近几年在空间灭菌领域得到了很大的应用。
与传统的甲醛熏蒸灭菌相比,干法VHP空间灭菌循环周期短,一般只需要4-6小时即可完成,并且无有害消毒剂残留,这一点可以满足CAR-T细胞的生产工艺特点,方便企业的生产时间管理;同时移动式的设备自带脚轮,可以随意移动部署,可对多个区域灵活灭菌,更加符合CAR-T细胞生产车间体积小但数量多,空调机组复杂的特点;与空调机组固定式的VHP灭菌相比,也更加安全,同时固定投资成本小,运行能源消耗成本低,便于企业提高经济效益。

德国PEA是一家专注于气化过氧化氢灭菌的公司,目前有两款不同型号的干法移动式气化过氧化氢发生器,可分别满足不同大小空间的灭菌需求:MLT zeta单台发生器最大灭菌体积可达600m³,适用于GMP车间,生物安全实验室等大体积空间的灭菌;MLT19ii单台发生器最大灭菌可达200立方,特别适用于CAR-T细胞治疗行业GMP车间的灭菌,体积小,灭菌周期短,部署灵活,灭菌效果可靠。


