▌写在前面
12月1日,新版《药品管理法》正式开始实施,这是该部法律自1984年颁布以来进行的第二次系统性、结构性的重大修改。其中对业内影响最为深远的一点或许要数GMP认证证书的取消:自2019年12月1日起,取消药品GMP、GSP认证,不再受理GMP、GSP认证申请,不再发放药品GMP、GSP证书。制药质量关乎人们的生命安全,人民用药安全重于泰山,GMP更是国际通行的药品生产质量管理基本准则,此时取消GMP认证又有着哪些深层次意义?
▌GMP认证的历史

1998年,中国参照国际标准首推GMP认证,对企业从厂房到地面、设备、人员和培训、卫生、空气和水的纯化等各项生产环节提出明确要求,并强调所有药品不通过认证不得生产。 2010年新版GMP落地,硬件部分参照欧盟相关标准,软件部分参照美国FDA相关标准,并要求所有药品生产企业在2015年年底之前拿到新版药品GMP认证,否则就被逐出市场,被业内称为“史上最严格认证”。而在今年8月26日表决通过的新版《药品管理法》中,“药品监督管理部门按照规定对药品生产企业是否符合《药品生产质量管理规范》的要求进行认证;对认证合格的,发给认证证书”等相关规定已被删除,当时业界普遍认为这或许意味着GMP认证证书在国内退出舞台。
▌“GMP认证”制度不可忽视的弊端
GMP认证证书由药品监管部门颁发,有效期5年,从某种角度来讲,就等于监管部门认可,该生产企业在5年内,其生产活动符合GMP规范。这就好比药厂传统的空间灭菌方式甲醛熏蒸,因为甲醛是强致癌物且难以完全去除,所以单次甲醛熏蒸需要至少24小时,灭菌一次停工2~5天,因此厂家通常隔较长的时间才进行一次熏蒸灭菌,但微生物污染源人、物、料、室外新鲜空气等却天天进出GMP车间,其带入的微生物不能得到及时杀灭,在一个灭菌周期很容易出现实际上微生物已经超标的情况。GMP是一个日常活动,并不是今天符合GMP规范,明天就一定会符合。很多企业都只是为了认证而认证,如认证前认证后两张脸,检查官一离开,马上就不按规范操作,这就让认证证书变成了违规操作的“遮羞布”。所以,有些国家只有GMP现场检查,没有GMP认证,如美国的FDA,现场检查结束不会颁发GMP证书,只会提供一份EIR报告。
▌“GMP认证”取消的深层意义
某种程度上,GMP和GSP认证的取消是一种简政放权、释放红利。GMP认证的取消标志着CFDA监管职能的转变与监管思路的厘清,一个回归科学监管本质的CFDA正向我们走来。政府审批事项的减少将给予企业更多的自主权,但这也要求企业需要具备更高的自我要求标准。这对于原本就重视质量管理的企业来说是好消息,但是对于那些惯于投机取巧、临时抱佛脚的企业来说就是威胁了。

自2019年12月1日起,凡持有药品注册证书(药品批准文号、进口药品注册证、医药产品注册证)的企业或者药品研制机构为药品上市许可持有人。新修订的药品管理法全面实施药品上市许可持有人制度。药品生产质量的第一负责人由厂家变为上市许可人,且应严格履行义务,依法对药品研制、生产、经营、使用全过程中药品的安全性、有效性和质量可控性负责。此时,如果仍然执行GMP认证,那么质量管理职责仍然在生产厂家身上,这会弱化上市许可持有人的相关职责。
取消GMP认证,对制药行业而言意味着更多、更严格和更科学的监管。从近两年来看,GMP认证取消趋势之下,一个重大的改变已经出现,即飞行检查的频次明显增多,已显示出常态化趋势。业内表示,检查力度趋严是一个必然趋势。取消GMP认证并不会降低药品质量标准,也不意味着药企生产门槛的降低,相反,药企将面临更加常态化和严苛的检查。据了解,7月18日,我国印发的《关于建立职业化专业化药品检查员队伍的意见》明确,构建国家和省两级职业化专业化药品检查员队伍,配备满足检查工作要求的专职检查员,为药品监管行政执法等提供技术支撑。国家不断强化飞行检查,细化了国家、省、市药监局的责任分工,日常监管逐渐代替了认证监管,GMP认证等存在的意义本来就有所削弱。在GMP车间空间灭菌领域,移动式的干法气化过氧化氢灭菌在灵活性方面得到了极大的提升,灭菌周期短,一方面基本不需要停工,不影响企业的生产安排,另一方面可轻松助力药企应对常态化的灭菌检查;灭菌工艺成熟,重复性好,有专门指示剂可进行灭菌效果验证,监管部门认可;最重要的是,灭菌效果好,无论是药企的周期性空间灭菌,抑或应对突发的染菌事件,气化过氧化氢灭菌均可使无菌保证水平降低至10-6以下,已成为各国药典、GMP、消毒灭菌技术规范所推荐的方法。
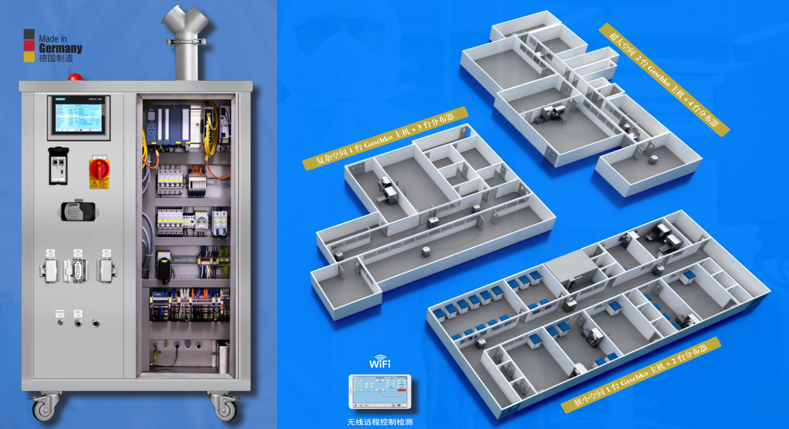
如今取消GMP和GSP认证,更多是表明未来如何去符合规范将变成药企自己的事。未来国家更加注重全过程监管。如药品管理法修正草案明确了药品质量安全追溯要求,药品上市许可持有人、生产经营企业、医疗机构应当建立、实施严格的追溯制度,保证全过程数据真实、准确、完整和可追溯。如在疫苗的研制、生产、流通、预防接种过程中应当采用信息化手段采集、留存追溯信息。德国PEA的MLTzeta气化过氧化氢发生器用于GMP车间的空间灭菌,可配置审计追踪功能,灭菌循环结束自动生成完整的灭菌报告,信息化数字化呈现过程监控关键数据,是干法移动式气化过氧化氢空间灭菌领域的绝佳选择。
▌结 语
GMP是药品生产的基本要求,GMP认证取消并不等于GMP取消,未来企业需要遵循的一系列GMP规范仍要遵守。总的来看,无论GMP认证是否取消,药企监管“涛声依旧”,对于药企而言,心存侥幸难以生存,只有扎实、规范生产管理,才能拥有更自信的未来。
如您需更多信息可联系我们
网址:www.alit.com.cn www.countstar.cn
电话:021-62299622 400-820-2912













