基于信使 RNA (mRNA) 的疫苗在 COVID-19 大流行期间获得了人们的认可。
这种传统疫苗的新型替代品之所以出现,有几个原因:一方面,mRNA疫苗仅编码一种特定抗原,体内半衰期可控,属于非插入性和非传染性的技术,使用非常安全[1]。另一方面,与基于细胞的生物制药生产相比,mRNA 的生产快速且易于扩展,具有较高的生产效率。mRNA疫苗的生产包括一系列工艺步骤,从生物反应器中的生产到随后的多步骤的纯化和配制。
然而,mRNA 疗法是一项新技术,相关技术平台在不断发展,工艺参数也在迅速变化[2]。Lucullus® 工艺过程信息管理软件是监控过程参数、记录工艺过程数据,从研发实验室到生产,从上游到下游中控制 mRNA 制造过程中所有步骤的过程控制的理想解决方案。
Lucullus® 的独立于供应商的整合能力和模块化架构为整合来自不同制造商和不同数据接口的设备提供了必要的灵活性。工艺流程的调整、实验的自动化和远程控制、培养基和缓冲液配方管理、样品管理都可以通过单一软件实现,同时它也符合GMP生产规范以及可以满足客户定制化需求。
mRNA疫苗
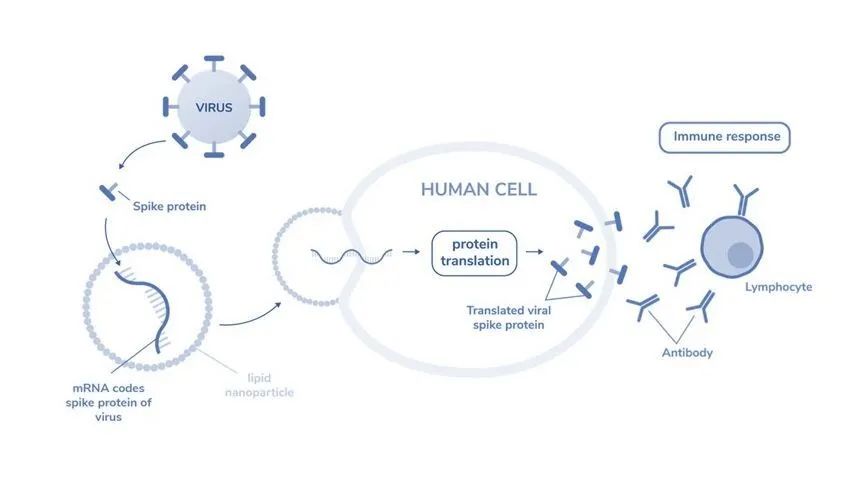
mRNA 疫苗基于类似的原理开发,不同于将灭活病毒或病毒蛋白引入体内, mRNA技术将一段mRNA引入体内,并根据指令产生特定的病毒抗原。为了有效地将 mRNA 分子递送到细胞质中,需要使用 mRNA 递送系统,包括病毒递送系统、基于脂质的载体、(阳离子)聚合物和多肽[3]。将 mRNA 递送到细胞的胞质中可能会触发靶蛋白的产生,该靶蛋白可以起到治疗或预防的作用,作为抗原触发用于疫苗接种目的的免疫反应,替换有缺陷的蛋白质,或触发抗肿瘤反应。因此,mRNA 疫苗还具有预防其他感染和治疗包括癌症、艾滋病毒、流感甚至遗传疾病在内的多种疾病的潜力[4]。
图1:mRNA编码病毒的刺突蛋白
与其他递送系统相比,腺相关病毒 (AAV) 等病毒递送系统已得到很好的研究并被批准作为疫苗和基因治疗的载体。病毒递送系统可能导致免疫原性和更频繁的全身副作用[5]。此外,其制造过程要复杂得多,基因治疗领域的应用需要更高的滴度。相比之下,为mRNA 生产过程中创建稳健的生产规模平台较为容易。公司一旦知道病原体的基因序列,就可以相对快速地设计出 mRNA 疫苗,从而可以专注于工艺开发。COVID-19 疫苗可能只是 mRNA 革命的开始。
mRNA制造过程
mRNA 疫苗的大规模生产包括一个或两个步骤的体外反应,然后通过多个步骤进行纯化,其中可能包括 DNase 消化、沉淀、层析或切向流过滤。
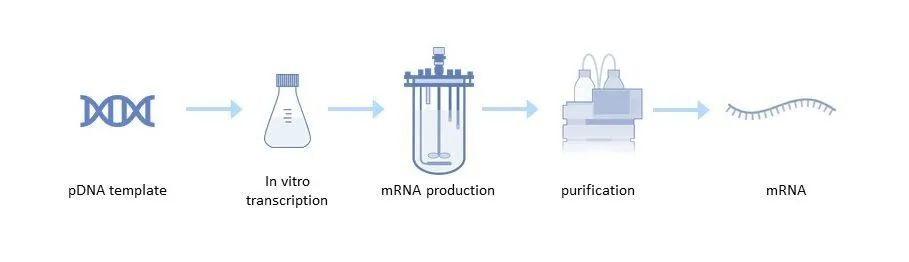
pDNA模板的生产
需要线性化以避免可能产生不希望的 mRNA 的转录事件。它是通过在反应缓冲液中将质粒 DNA 与限制性内切酶混合来实现的 [1]。然后通过切向流过滤 (TFF) 或色谱法去除限制性酶、BSA、DNA 片段、内毒素等杂质。
体外转录
下一步是体外转录,其中作为 DNA 模板的线性pDNA 被转录成 mRNA。这种酶促反应使用自然转录过程的元素,包括 RNA 聚合酶和核苷酸三磷酸。转录后,最终的 mRNA 结构需要一个 5' 帽结构才能在细胞中稳定且有效地翻译[4]。
mDNA纯化
在体外转录步骤之后,需要进一步纯化 mRNA,包括内毒素、免疫原性双链 RNA (dsRNA)、DNA 模板残基、RNA 聚合酶和元素杂质。有几种方法可用于 mRNA 纯化,例如 TFF 或色谱步骤,包括反相离子对、阴离子交换和带有聚 (dT) 分离的亲和色谱 [5]。
纯化后,进行最终浓缩和渗滤以最大限度地提高产品纯度,并将 mRNA 转移到适当的缓冲液中进行制剂或储存。
图2:mRNA生产过程
脂质纳米颗粒 (LNP)
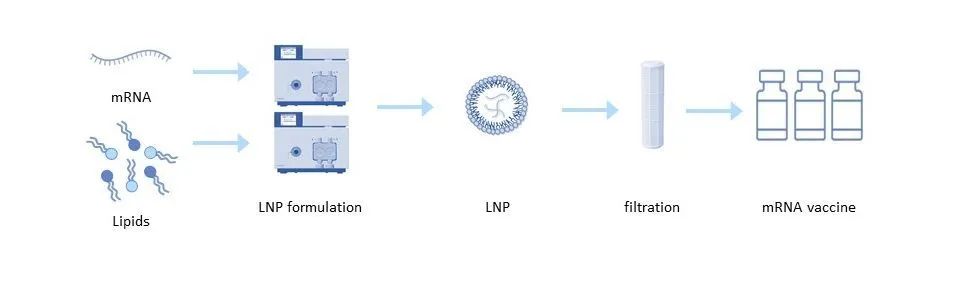
递送工具对于 mRNA 疫苗和治疗的有效性同样重要。脂质纳米颗粒 (LNP) 最常用于 mRNA 递送。每个脂质纳米颗粒由四种不同的脂质组成,它们允许 mRNA 在内部运输并防止其降解。这些脂质还负责将 RNA 有效释放到细胞质中。阳离子脂质的结构对LNP的活性、毒性和生物分布有很大影响,进而影响体内潜在的毒性作用[6]。为了在最终配方中获得可重复的结果,需要一致的脂质质量,这取决于用于合成脂质的原材料的质量和脂质本身的相应材料特性。
图 3:脂质纳米颗粒配方
可以使用多种技术将纯化的 mRNA 配制成递送颗粒。在普通溶剂注射技术中,脂质溶解在溶剂如乙醇中,并在含有 mRNA 的低 pH 水性缓冲液中快速混合。然后将低 pH 缓冲液渗滤到中性缓冲液中,再通过超滤浓缩颗粒 [5]。
使用 Lucullus® 进行工艺过程监控
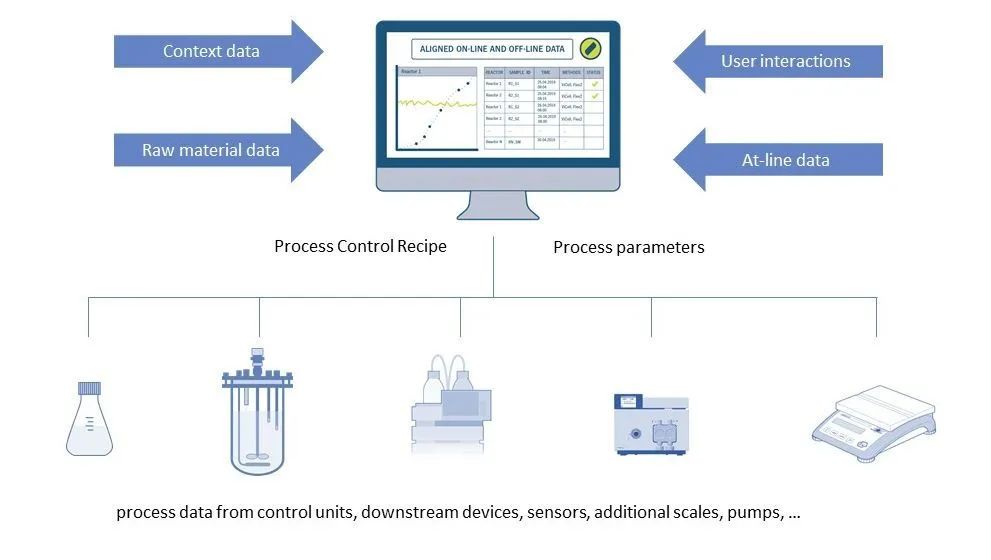
不同的设备用于上述各个工艺步骤。从简单的传感器、秤和泵到复杂的生物反应器控制系统和色谱系统。这些设备通常来自不同的制造商。同时不同型号的设备增加了安装的复杂性。许多公司的目标是收集每个工艺步骤中所有设备的数据,并将其存储在单个数据库中以进行监控和审查。在某些操作单元(例如,上游生物反应器、LNP 制剂),公司还希望实现自动化和远程控制过程。由于该软件需要在 GMP 环境中运行的,因此公司必须根据需要的文件执行必要的 IQ/OQ 测试。Lucullus® 工艺过程信息管理系统(Securecell AG,瑞士),其第一个版本于 1995 年发布,是用于生物过程管理和控制的全面而强大的中央数据中心。Lucullus® 提供了一个统一的、灵活的和对科学家友好的 SCADA 功能。它被设计为一个集中的数据采集、监控和控制平台,用于上游和下游开发,以协调和控制各个设备之间的交互活动。
图 4:Lucullus® 流程信息管理软件
Lucullus 的设备独立性和模块化架构提供了集成来自不同制造商和不同数据接口的设备以及执行所有过程自动化任务的灵活性。在线设备数据(来自工艺过程单元)与来自在线或离线分析的基于样本的结果融合,也可用于过程控制。内置培养基管理可实现储配液间活动(缓冲液、补料、培养基)的数字化,同时提供清晰的工作流程,将培养基制备记录链接到工艺单元,以实现原材料和工艺结果的可追溯性。结合Securecells 的 PAT 系统,即 Numera®自动取样与样品处理系统,Lucullus® 涵盖了工艺过程的取样计划、实时取样和在线和离线分析仪器的数据处理。Securecell 推出的 Lucullus® 工艺过程信息管理软件结合生物工艺数字化的最新科技为mRNA 疫苗开发和生产领域的客户提供强大且灵活的解决方案。
References
[1].Pardi, N., Hogan, M., Porter, F. et al. mRNA vaccines — a new era in vaccinology. Nat Rev Drug Discov 17, 261–279 (2018). https://doi.org/10.1038/nrd.2017.243
[2].Sartorius AG. The Next Generation of Vaccines Therapies – mRNA Vaccines. www.sartorius.com, 2022. [Internet]
[3].Rosa SS, Prazeres DMF, Azevedo AM, Marques MPC. mRNA vaccines manufacturing: Challenges and bottlenecks. Vaccine. 2021 Apr 15;39(16):2190-2200. doi: 10.1016/j.vaccine.2021.03.038.
[4].Sara Sousa Rosa, Duarte M.F. Prazeres, Ana M. Azevedo, and Marco P.C. Marques. mRNA vaccines manufacturing: Challenges and bottlenecks. Vaccine. 2021 Apr 15; 39(16): 2190–2200
[5].Laurens Vergauwen, Dr. Nargisse El Hajjami, Mag. Manuel Brantner, Dr. Shiksha Mantri and Bahar Cebi. Manufacturing Strategies for mRNA Vaccines and Therapeutics. BioProcess Online. [Internet]
[6].Bancel S, Issa J, Aunins J. Ribonucleic acid purification (Patent No. WO2014152031A1). [Internet]