2018年9月,美国药典(USP-NF)出台了关于细胞冷冻保存的政策,文中明确提出,对于冻存复苏的样本,类似于台盼蓝的染料来检测细胞完整性的方法用的越来越少,因为其不能很好的辨别冻存和复苏的细胞,这种检测方法经常需要特定细胞种类并且指定合适的浓度和时间。当下荧光染料越来越多的应用于复苏细胞的浓度活率检测。USP-NF建议至少选用两种方法对复苏后的细胞进行活率检测。详情请参考《USPGeneral Chapter <1044> Cryopreservation of Cells》。
冻存复苏的过程中,细胞损伤是不可避免的,细胞浓度活率计数在冻存和复苏的各个环节至关重要。例如,如果冻存前的细胞浓度或活率过低,会导致细胞复苏后生长缓慢或者无法生长。目前细胞计数方法主要是台盼蓝染色法计数、库尔特法及荧光染料法计数。其中台盼蓝染色方法,因为其对蛋白质有很强的亲和力,需要用到不含血清的稀释液效果才会更好;另外,刚复苏的样本,台盼蓝染色结果不稳定。库尔特法主要是根据细胞大小来区分细胞活率,更适合于纯的细胞系的检测。
实际实验过程中,很多客户也碰到冻存复苏的样本活率计数问题。下面我们根据药典的建议,对冻存复苏的样本活率计数的问题进行解析和实验证明。
01
细胞存储方法
细胞冻存是细胞保存的主要方法之一,主要用于细胞保种,同时也可用于购买、寄赠、交换和运输。近年来,干细胞的研究越来越被人们关注,当下最热门的就是将自身或异体的健康的干细胞储存起来,可以在自身或亲属患病时启用细胞治疗的方法,使一些病症能得到有效治疗,为生命储存一份保险。目前长期存储的方式大多采用-196度的液氮保存。
02
细胞冻存复苏过程中,影响细胞活力的因素
直接冻存细胞时,细胞内和外环境中水都会形成冰晶,能导致细胞内发生冰晶损伤、电解质升高、脱水、蛋白变性等,能引起细胞死亡。所以在细胞冻存液中必须要加入冷冻保护液,通过降低冰点,然后在缓慢冻结的条件下使水份在冻结前透出细胞,最后存储在-130℃以下来减少冰晶的形成,从而保护细胞中一些重要的蛋白质和细胞器的功能。常用的保护剂主要是二甲亚砜(DMSO)和甘油。细胞复苏的时候要快速,让细胞迅速通过细胞最易受损的-50-0℃,从而保证细胞仍然可以生长、活力受损不大。
细胞冻存过程的制约因素:
1、需要存储的细胞状态,处于指数生长期、密度合适、状态好的样本冻存复苏效果好一些;所以冻存前的细胞需要确定其活率和浓度;
2、程序性降温步骤的控制,即冷冻速度的控制,过慢会导致细胞外溶质损伤,过快则会导致细胞内产生冰晶;
3、冻存过程细胞无污染;
4、冷冻保护剂的选择。
细胞复苏过程的制约因素:
1、37℃水浴,在1-2分钟内快速解冻,使细胞内不会形成较大的冰晶,也不会暴露在高电解质的溶液中过长,从而继续保持正常的结构和功能;
2、冷冻保护剂的去除,例如常温下,DMSO对细胞毒性作用比较大。
03
利用台盼蓝和AO/PI荧光染料法来精确测量冻存复苏的细胞样本
1、AO/PI染色法检测原理
吖啶橙(Acridine orange,AO)和碘化丙啶(Propidiumiodide,PI)都可以对死、活细胞核中的DNA进行染色。染色原理如图1所示。该方法可以有效区分死细胞和碎片,以及减少细胞折光率改变对染色效果的影响。

图1:AO/PI染色法检测原理
2、培养过程中及冻存复苏后MSC细胞计数
培养过程中,MSC细胞台盼蓝染色方法与AO/PI染色方法结果对比如图2和表1所示。
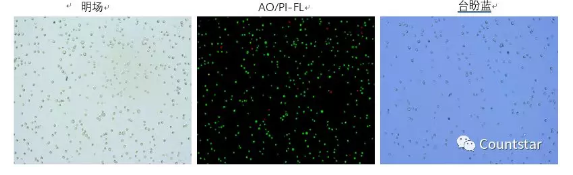
图2. 培养过程中MSC细胞AO/PI及台盼蓝计数结果原始图片
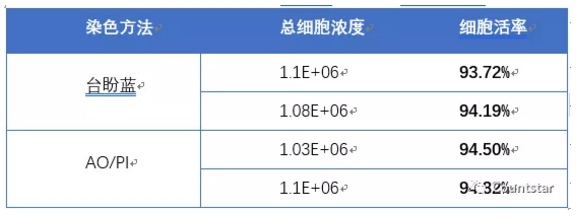
表1. 培养过程中MSC细胞AO/PI及台盼蓝计数浓度及活率对比
结论:培养过程中MSC细胞AO/PI及台盼蓝计数浓度及活率无明显差异。
冻存复苏的ASCs细胞台盼蓝染色方法与AO/PI染色方法结果对比如图3和表2所示。
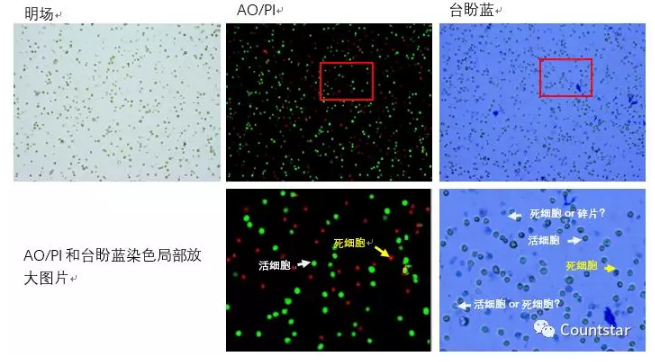
图2. 冻存复苏的ASCs细胞AO/PI及台盼蓝计数结果原始图片
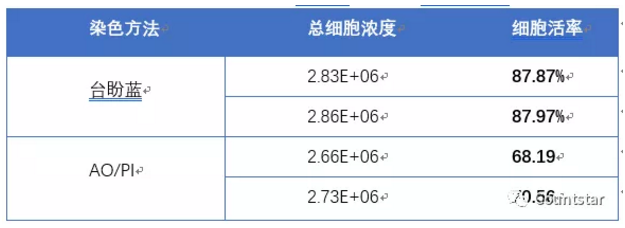
表2. 冻存复苏的ASCs细胞AO/PI及台盼蓝计数浓度及活率对比

结论:对于本次实验样本,冻存复苏的ASCs细胞AO/PI计数结果细胞活率明显低于台盼蓝计数,图片中也可以看出,AO/PI计数死活细胞区分更加明显,而台盼蓝计数结果中有些碎片和台盼蓝染色不明显的细胞无法区分。
3、 运输过程中的ASCs细胞台盼蓝染色方法与AO/PI染色方法结果对比如图4和表3所示。
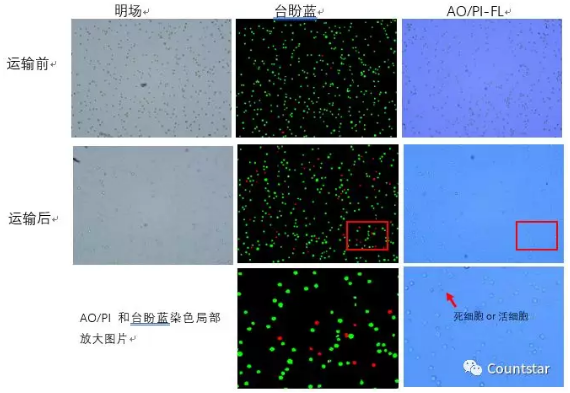
图4. 运输前后的ASCs细胞AO/PI及台盼蓝计数结果原始图片
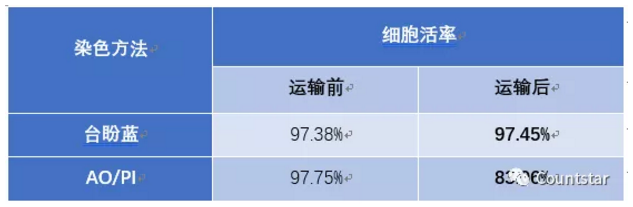
表3 运输前后的ASCs细胞AO/PI及台盼蓝计数活率对比结果
结论:运输前细胞状态好,台盼蓝与AO/PI计数结果无明显差异;运输后的细胞样本,台盼蓝计数结果与运输前无明显差异,但是AOPI计数结果明显低于台盼蓝计数;从图4中也可以明显观察到,运输后的样本中,台盼蓝染色的图片中有些细胞被台盼蓝染色非常浅,肉眼判断死活非常困难。
综上,从上述实验结果中观察到,不管是培养过程中还是运输前的状态比较好的细胞样本,台盼蓝计数与AO/PI荧光计数结果细胞活率保持一致;但对于冻存复苏及运输后复苏的样本,AO/PI活率明显比台盼蓝计数结果低。类似的实验结果在很多地方得到验证,活率计算结果差异大小依据冻存效果不同有所波动。所以对于冻存复苏的样本,选择countstar Rigel AO/PI荧光方法计数能更精确的区分冻存复苏细胞死活,从而反映更加真实的细胞活力状态,实验人员可以根据实际情况选择最适的计数方法。
04
总结
1、上述实验结果证明,细胞状态好的样本,用台盼蓝计数与AO/PI两种方法计数得到的细胞活率结果一致;
2、复苏后的样本中,一些状态不好的细胞台盼蓝染色可能不太清晰,台盼蓝染色特异性不太好,计数结果可能会带来较大的误差,使用AO/PI双荧光法计数,死、活细胞区分更加清晰,可以得到更加精确的结果;但是两种方法计数活率差异程度也会依赖于冻存方法和冻存前的细胞状态等。
3、我们通过实验验证了美国药典1044期中强调的冻存复苏细胞活率计数问题。对于冻存复苏的细胞活率检测,现在越来越多的应用荧光的方法,建议大家至少选用两种方法对复苏后的细胞进行活率检测。
(PS: 仅限于研究用途, 不可用于诊断操作)


